-
友情链接:
《自然》研究发现:“产油”竟能帮癌细胞免疫逃逸
- 发布日期:2024-08-11 16:03 点击次数:123
有句话叫“甲之蜜糖,乙之砒霜”,它适用的情景还真不少,比如各位重视健康和身材管理的朋友,听到油脂肯定是一脸嫌弃,但在营养物质匮乏的肿瘤微环境里,各种脂质可是会被癌细胞疯抢或努力合成的重要“战略资源”,而且它们的作用还不仅仅限于供能呢。
在《自然》杂志上,一项由美国洛克菲勒大学研究团队主持开展的研究成果就显示,磷脂类物质中鞘糖脂(Glycosphingolipid)的合成,就对KRAS突变驱动的肿瘤成功实现免疫逃逸至关重要:鞘糖脂合成水平与癌细胞表面的干扰素γ受体1(IFNGR1)数量多寡挂钩,阻断鞘糖脂合成会使IFNGR1增多,就让癌细胞更容易被抗肿瘤免疫应答消灭。

论文首页截图
虽说学界早就发现了各种脂质促癌症进展和转移的作用,但还很少把“罪名”具体落到某一种具体的脂质分子上,这显然还不足以为精准干预策略指明方向,所以在本次研究中,洛克菲勒大学研究团队对KRAS突变型胰腺导管腺癌(PDAC,使用HY15549细胞系)开展了功能基因组学和脂质组学分析,以期找到对免疫逃逸有关键作用的脂质分子。
基因集富集分析(GSEA)显示,与植入到清髓小鼠体内的癌细胞相比,在免疫健全小鼠体内成功存活并成瘤的PDAC细胞,合成鞘脂类分子及磷脂酰胆碱、磷脂酰乙醇胺的能力明显增强,提示它们可能与免疫逃逸相关,而汇总GSEA及脂质组学分析结果后,作为细胞膜重要成分之一的鞘糖脂,就成了唯一的“犯罪嫌疑人”。
鞘糖脂与PDAC细胞成功实现免疫逃逸有关
研究者们随即在实验中证实,敲除或敲低鞘糖脂从头合成过程所需的关键酶编码基因(Sptlc1/Sptlc2),即可显著抑制肿瘤生长,且先天免疫和适应性免疫应答均参与了抑癌:敲除相关基因后对肿瘤微环境的分析显示,NK细胞和CD8+T细胞都会赶来杀伤癌细胞。
那么问题来了,合成鞘糖脂为什么能帮PDAC细胞逃避免疫系统的追杀呢?共培养实验显示,因敲除Sptlc1/Sptlc2而不能合成鞘糖脂的癌细胞与NK细胞或T细胞共培养时,细胞内干扰素信号相关基因表达均发生了显著上调,其中作用最不可或缺的是干扰素γ(IFNγ)。
蛋白组学分析证实,敲除Sptlc1/Sptlc2使癌细胞的膜蛋白丰度发生了剧变,水平上调最明显的就有干扰素γ受体1(IFNGR1),意味着癌细胞更容易与NK细胞或T细胞分泌的IFNγ结合,随后被迫启动JAK-STAT通路,诱导抗原呈递过程和促炎性细胞因子的产生,这些可都是有利于抗肿瘤免疫应答的利好信号,自然是癌细胞想要极力避免的。
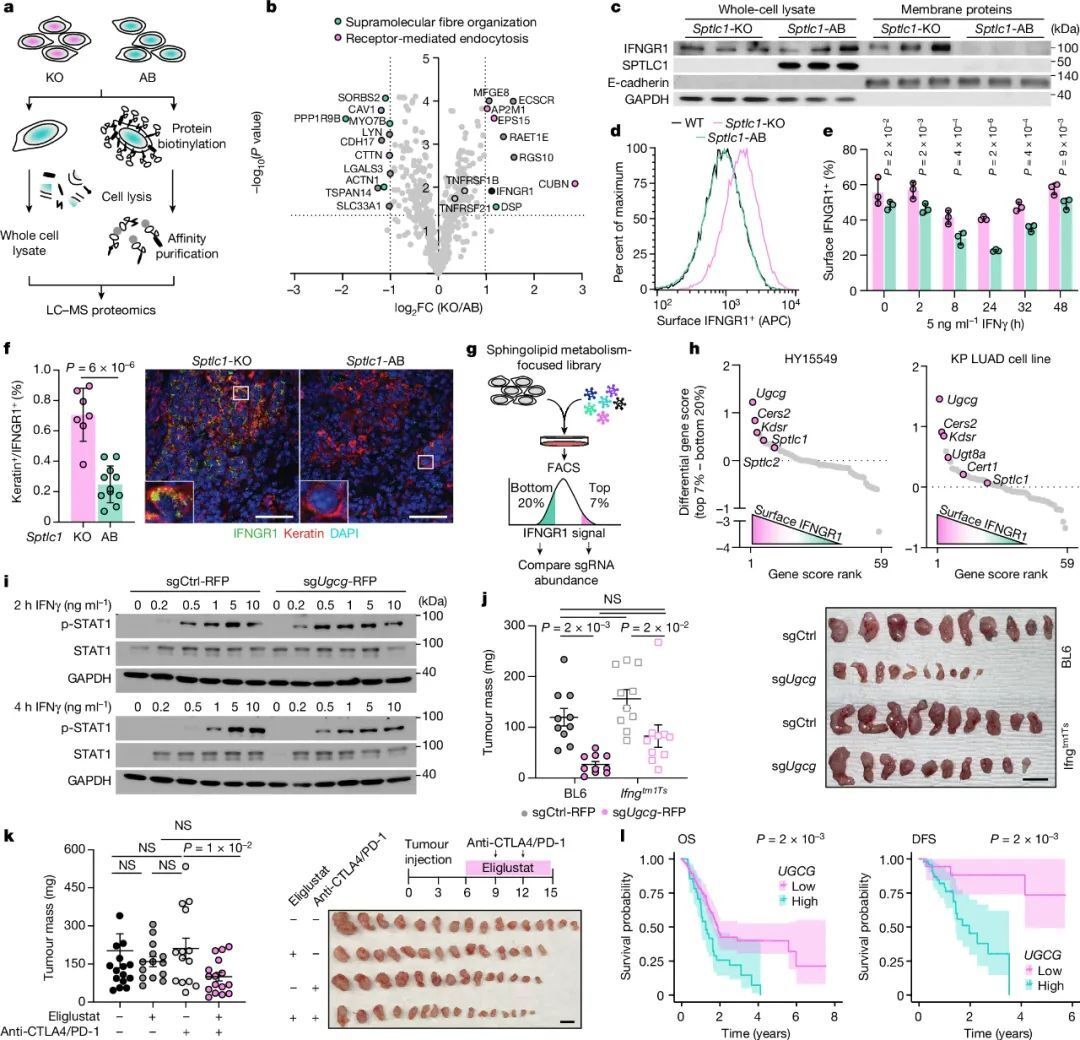
鞘糖脂合成决定了癌细胞膜表面的IFNGR1水平
借助CRISPR筛选技术,研究者们还证实鞘糖脂是唯一影响IFNGR1水平的鞘脂类分子,敲除仅参与鞘糖脂合成的UGCG酶编码基因,即可上调IFNGR1表达;而凑巧的是,临床上用于治疗罕见病戈谢氏病的药物艾格司他(Eliglustat)就能抑制UGCG活性,将它与免疫检查点抑制剂(PD-1+CTLA-4抑制剂双免疫疗法)联合使用,果然实现了协同增效。
研究者们表示,下一步探索的方向是明确鞘糖脂合成对癌细胞IFNGR1水平的影响,是否仅局限于KRAS突变型肿瘤,这将直接决定干预策略的适用范围,但即使仅限于存在KRAS突变的癌症,从中可能受益的患者都数不胜数,肺癌、肠癌、胰腺癌,哪个不是治疗棘手的顽敌?
相关资讯
-
著名专家称: 试管婴儿都活不过40岁! 如今首例过得如何?
- 业务范围 2024-08-22
- 本文内容均引用权威资料结合个人观点进行撰写,具体信息来源已赘述在文章结尾 前言 1988年3月10日,中国首例试管婴儿顺利诞生。 后来她被取名为“郑萌珠”,“萌”寓意着萌发,代表着试管婴儿这项医学技术正在萌发,而“珠”则是为了答谢一直悉心呵...
-
热火官推詹韦连线! 詹姆斯降维打击!
- 业务范围 2024-10-14
- 这一张图确实唤醒了太多球迷的回忆了,那些年詹姆斯的热火生涯,那些年的三巨头,那些年的詹韦连线,那些年的面具詹...有太多经典镜头直到现在依旧深深的刻在我们的脑海里。 近日,据Marc Stein报道,湖人在2023-24赛季的交易截止日前,...
-
韩版模拟人生《inZOI》将开启限时捏脸 数据可继承至正式版
- 业务范围 2024-08-25
- 由《PUBG》的开发商Krafton打造的韩版生活模拟游戏《inZOI》即将于8月21日至8月26日,在Steam平台上将限时推出“捏脸”工具。玩家能够创造自己独特的角色,并在游戏正式版中继续使用。 在这个游戏中,玩家不仅可以定制角色的外观...
